《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于《体外诊断试剂注册管理办法》的管理范围。

《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于《体外诊断试剂注册管理办法》的管理范围。
文件名称 | 文号 |
《医疗器械监督管理条例》 | 国务院令第680号 |
《体外诊断试剂注册管理办法》 | 国家食品药品监督管理总局令第5号 |
《医疗器械说明书和标签管理规定》 | 国家食品药品监督管理总局令第6号 |
《医疗器械生产监督管理办法》 | 国家食品药品监督管理总局令第7号 |
国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告 | 2014年第64号 |
关于发布医疗器械产品技术要求编写指导原则的通告 | 2014年第9号 |
关于发布体外诊断试剂说明书编写指导原则的通告 | 2014年第17号 |
关于印发境内第三类和进口医疗器械注册审批操作规范 | 食药监械管〔2014〕208号 |
关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告 | 2014年第44号 |
关于医疗器械生产质量管理规范执行有关事宜的通告 | 2014年第15号 |
关于公布医疗器械注册申报资料要求和批准证明文件格式的公告 | 2014年第43号 |
关于发布体外诊断试剂临床试验技术指导原则的通告 | 2014年第16号 |
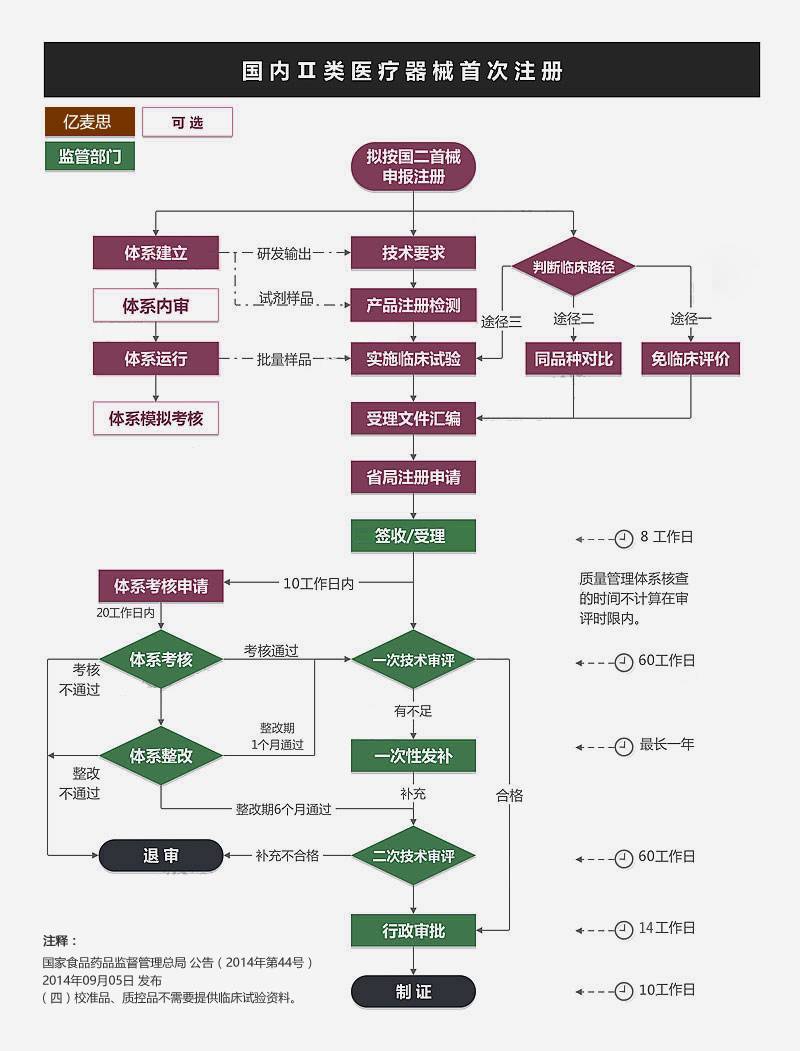
预算、合同、考虑期,1个月。
资料提供,视客户情况而定 1个月
产品检测,视产品情况有所变化。平均3个月
临床试验不可与检测并行,临床应单独核算时间。至少9个月
注册资料编制可与检测或临床并行。
NMPA法定消耗预算8个月。(158工日,20工日/月,不计节假) 至少8个月
发补资料准备时限0~12个月视产品首次申报资料情况而定。平均6个月
*体系考核,注册受理后,额外30工作日 1.5个月
无临床试验国二械首 预算平均19个月
有临床试验国二械首 预算应考虑28个月。
注册过程策划服务
首次注册服务
体系建立指导服务
体系运行核查服务
体系模拟考核服务
临床试验服务
注册、体系、临床培训服务
临床评价资料撰写服务
生产许可服务