2019年8月1日,NMPA发布《国家药监局关于扩大医疗器械注册人制度试点工作的通知》(国药监械注〔2019〕33号),明确北京、天津、河北、辽宁、黑龙江、上海、江苏、浙江、安徽、福建、山东、河南、湖北、湖南、广东、广西、海南、重庆、四川、云南、陕西这21个地区的企业及科研机构均可成为注册人。
随后,浙江、河北、黑龙江、湖北、河南等地陆续对《医疗器械注册人制度试点工作实施方案》进行意见征求,之后正式发布各试点省份医疗器械注册人制度正式实施方案,明确将在各试点省份内开展医疗器械注册人制度跨省委托生产,相信不久的未来医疗器械注册人制度将在全国实施。
医疗器械注册人制度,即现行医疗器械法规背景下的上市许可持有人制度。该制度下,符合条件的医疗器械注册申请人可以单独申请医疗器械注册证,然后委托给有资质和生产能力的企业生产,从而实现医疗器械产品注册和生产许可的“解绑”。
此前,我国医疗器械行业实行产品注册和生产许可“捆绑”模式,注册人须自己设厂生产产品,如要委托生产,双方必须同时具备该医疗器械注册证。
试点医疗器械范围包括境内第二类、第三类医疗器械(含创新医疗器械)。
注意:一类医疗器械不在范围内。在药监总局《关于发布禁止委托生产医疗器械目录的通告》(2014年第18号)目录内的医疗器械也不在委托范围内。
1、省费用:这是*直接的好处,在于注册人可以不用自己设厂生产了,可以委托生产。以前一款产品从研发到上市至少要33个月,现在可以省去办厂的费用。
2、责任的划分:原先由于自行设厂办注册证,责任由注册证拥有企业自行承担;注册人制度后,责任由注册证拥有人及被委托生产企业共同承担。
3、允许医疗器械注册人直接委托试点省份医疗器械生产企业生产产品和样品;允许注册人多点委托生产,注册人在获批首家生产后,可以再委托其他生产企业生产。允许受托生产企业提交委托方持有的医疗器械注册证申请生产许可等。
满足相应的条件的医疗器械生产企业、生产企业、研发机构、科研人员。
医疗器械注册人必须具备对上市医疗器械全生命周期管理的能力,对医疗器械设计开发、临床试验、生产制造、销售配送、售后服务、产品召回、不良事件报告等承担全部法律责任。
从条件设定上,《试点工作实施方案》要求注册人应当配备法务、质量管理以及售后服务的全职专业团队。
法务团队负责政策法规的宣贯落实,**产品的质量和安全达到标准;
质量管理团队负责管理受托方及接收产品,确认委托方各项活动的落实;
售后服务团队负责上市后信息收集及产品质量分析,做好产品上市后监测和报告。
从能力要求上,《试点工作实施方案》要求注册人有能力选好管好受托企业,做好受托企业综合评价报告;有能力开展企业内部质量管理评审,做好年度质量管理体系自查报告;有能力对委托生产引发的风险承担责任,做好商业责任险的购买,倒逼注册人落实主体责任,建立医疗器械注册人承担全部质量责任和法律责任的**体系。
被受托生产企业履行《医疗器械监督管理条例》、其他相关法律法规以及委托合同、质量协议规定的义务,并承担相应的法律责任。负责按质量协议约定的技术要求和质量标准生产,对医疗器械注册人及医疗器械相关法规负相应质量责任,负责生产放行。受托生产企业发现上市后的医疗器械发生重大质量事故的,应当在24小时内报告省食品药品监督管理局和医疗器械注册人,省食品药品监督管理局应当立即报告国家食品药品监督管理总局。
对于符合《试点工作实施方案》要求的医疗器械注册申请人,第二类医疗器械注册向省食品药品监督管理局提出申请,可通过各省局官网“在线申报”栏目中将有相应的办事指南供申请人参考。除须满足申报资料的一般性要求外,还应当包含能证明相关设计开发技术文件(如技术要求、生产工艺、原材料要求、说明书和包装标识等)已有效转移给拟受托生产企业的资料。涉及第三类医疗器械注册事宜的,应按相关规定向国家食品药品监督管理总局提出申请。
以广东省为例:
1、申请:符合《广东省医疗器械注册人制度试点工作实施方案》的申请人,可以通过电子邮箱:gddaqxzcr\@gd.gov.cn向广东省药品监督管理局提出申请,并提交以下文档:1)医疗器械注册申请人和受托方基本情况;2)委托生产模式;3)产品基本信息、产品分类确定的依据;4)委托方提供产品设计开发文档;5)委托方提供质量管理体系运行情况的报告;6)委托方对受托方的质量管理、综合生产能力的评估报告;7)委托合同或协议、质量协议。
2、公示:省药监局对符合《方案》的申请人进行公示。
3、其他:1)根据《国家药监局关于扩大医疗器械注册人制度试点工作的通知》(国药监械注〔2019〕33号),申请人扩大到住所位于广东省辖区内的法人机构,受托人扩大到该文件中明确参与试点省(自治区、直辖市)的医疗器械生产企业。2)申请人试点资格公示后,如不再进行试点的,通过电子邮箱告知省药监局不再参加试点工作。
1、已取得医疗器械注册证产品,可以申请走注册人将生产委托出去吗?是不是直接走委托生产更好,受托企业有相应生产范围的生产许可。
答:已获证的产品,可以走注册人制度,在注册人制度试点的时候,就有很多企业转移的这个,走“登记许可事项变更”。部分省份如湖南省,在湖南新注册一个公司,可以把注册证转移过来,然后委托湖南的企业生产。
直接走委托生产,能省下建厂的费用。如果有足够预算,建议自行建厂。委托生产就意味着你的产品生产工艺,如果是高精尖的产品,有可能得不偿失。这方面的顾虑需要注意。
| 主管部门 | 管理类别 | 首次注册 | 注册变更 (许可事项变更) |
延续注册 (五年一次) |
相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|
| 省 局 |
1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 | 闽价费〔2018〕187号 | 2018/9/11 |
| 2 | 江西省 | Ⅱ | 5.467 | 2.289 | 2.268 | 赣发改收费[2020]73号 | 2020/2/6 | |
| 3 | 上海市 | Ⅱ | 6.573 | 2.751 | 2.73 | 工信部联企业[2011]300号 | 2018/5/9 | |
| 4 | 海南省 | Ⅱ | 5.81 | 2.408 | 2.387 | 琼发改收费〔2020〕351号 | 2020/5/27 | |
| 5 | 山东省 | Ⅱ | 5.754 | 2.408 | 2.387 | 鲁发改成本〔2020〕949号 | 2020/08/21 | |
| 6 | 安徽省 | Ⅱ | 5.005 | 2.093 | 2.079 | 皖发改价费函〔2019〕361号 | 2019/10/22 | |
| 7 | 浙江省 | Ⅱ | 6.573 | 2.2008 | 2.184 | 省疫情防控〔2020〕24号 | 2020/7/1至2020/12/31 | |
| 8 | 山西省 | Ⅱ | 4.2315 | 1.6275 | 1.6275 | 晋发改收费函〔2020〕86号 | 2020/4/16 | |
| 9 | 云南省 | Ⅱ | 4.28 | 1.75 | 1.75 | 云价收费函〔2018〕17号 | 2018/3/16 | |
| 10 | 河北省 | Ⅱ | 7.23 | 3.03 | 3 | 冀价费函〔2016〕210号 | 2016/10/1 | |
| 11 | 江苏省 | Ⅱ | 5.915 | 2.471 | 2.457 | 苏发改收管发[2019]91号 | 2019/2/13 | |
| 12 | 宁夏 | Ⅱ | 1.5 | 0.65 | 0.65 | 宁药监〔2019〕29号 | 2019/12/18 | |
| 13 | 黑龙江 | Ⅱ | 5.76 | 2.416 | 2.4 | 黑政办规〔2017〕33号 | 2017/8/1 | |
| 14 | 广东省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粤发改价格函〔2019〕666号 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘发改价费〔2019〕224号 | 2019/4/11 | |
| 16 | 四川省 | Ⅱ | 3.95 | 1.65 | 1.65 | 川发改价格〔2019〕491号 | 2019/11/27 | |
| 17 | 贵州省 | Ⅱ | 4.29 | 1.76 | 1.76 | 黔发改收费〔2017〕1589号 | 2017/10/17 | |
| 18 | 广西 | Ⅱ | 7.57 | 3.16 | 3.14 | 桂价医函〔2017〕536号 | 2017/12/29 | |
| 19 | 辽宁省 | Ⅱ | 5 | 2.1 | 2.1 | 辽发改收费〔2020〕299号 | 2020/6/12 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政发〔2020〕4号 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | |||
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | |||
| 23 | 重庆市 | Ⅱ | 0 | 0 | 0 | 渝府办发〔2019〕56号 | 2019/5/15 | |
| 24 | 甘肃省 | Ⅱ | 0 | 0 | 0 | |||
| 25 | 新疆 | Ⅱ | 0 | 0 | 0 | |||
| 26 | 内蒙古 | Ⅱ | 0 | 0 | 0 | 内发改费字〔2019〕773号 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京发改[2019]569号 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 天津发改委 | 2019/1/4 | |
| 29 | 陕西省 | Ⅱ | 0 | 0 | 0 | 陕yjj/2020-00009 | 2020/1/10 | |
| 主管部门 | 管理类别 | 首次注册 | 变更注册 (许可事项变更) |
延续注册 (五年一次) |
临床试验申请费 (高风险医疗器械) |
相关文件 | 实施日期 | |
|---|---|---|---|---|---|---|---|---|
| 国家局 | 境内 | Ⅲ | 15.36 | 5.04 | 4.08 | 4.32 | 局令15年53号 | 2015/5/27 |
| 文件名称 | 文号 |
|---|---|
| 关于扩大医疗器械注册人制度试点工作的通知 | 国药监械注〔2019〕33号 |
| 关于实施《湖南省医疗器械注册人制度试点工作实施方案》的通知 | 湘药监发〔2019〕29号 |
| 福建省医疗器械注册人制度试点工作实施方案 | |
| 《长江三角洲区域医疗器械注册人制度试点工作实施方案》政策解读 | |
| 山东省药品监督管理局关于印发《山东省医疗器械注册人制度试点工作实施方案》的通知 | 鲁药监注〔2019〕58号 |
| 广西壮族自治区药品监督管理局关于印发广西医疗器械注册人制度试点工作实施方案的通知 | |
|
辽宁省药品监督管理局公开征求《辽宁省医疗器械注册人制度试点工作实施方案》意见 |
|
| 河北省药品监督管理局关于印发《河北省医疗器械注册人制度试点工作实施方案》的通知 | |
| 黑龙江省药品监督管理局关于印发《黑龙江省医疗器械注册人制度试点工作实施方案(试行)》的通知 | 黑药监规〔2019〕9号 |
| ...... | ...... |
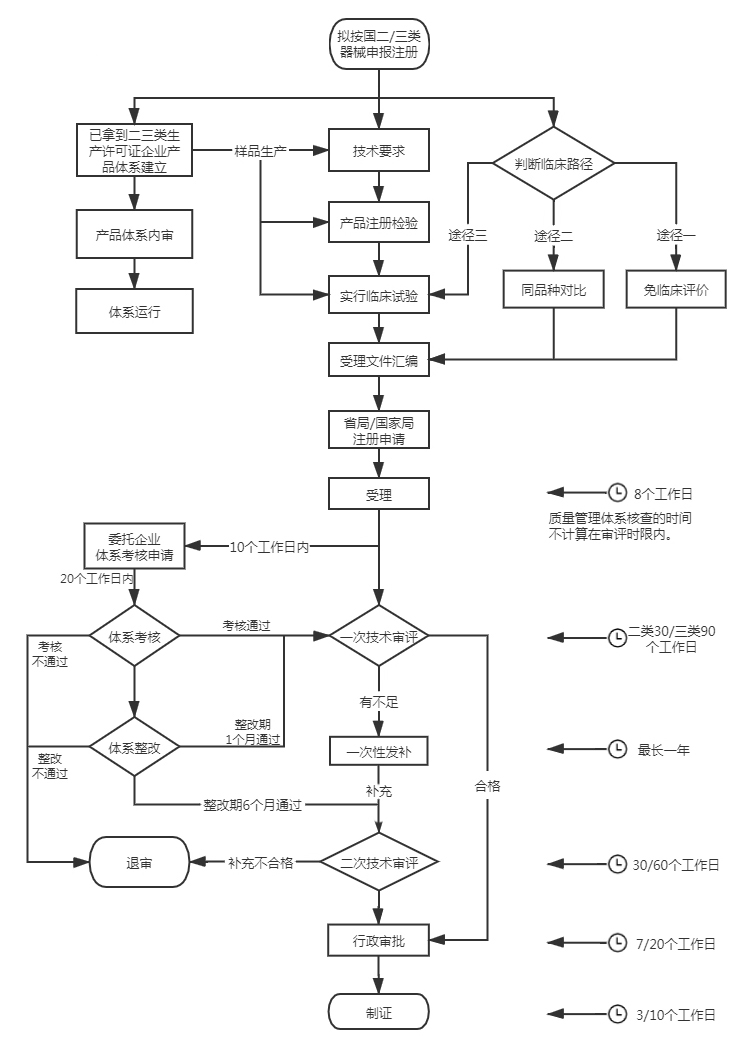
预计4-7个月,不含开发过程时间(并行)。
如需临床预计6个月以上1年左右,视产品而定。
申报注册全过程预算8个月。(158工日,20工日/月,不计节假),体考时间(并行),不含整改、资料发补耗时。
发补时限0~12个月,考虑平均时间2个月。视产品首次申报资料情况而定。
注册人制度下,默认体系已经符合药监核查要求。
不含临床周期,预计在1年左右;
含临床周期,预计在1年半到3年左右,甚至更长。
不含临床周期,二类医疗器械注册人在4-6个月内帮您下证;三类医疗器械注册人在12-18个月帮您下证。
含临床周期,二类在10-12个月帮您下证;三类医疗器械在18-36个月内下证。
当然具体情况具体分析。