根据《医疗器械监督管理条例》(国务院令第680号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅰ类是风险程度低,实行常规管理可以**其安全、有效的医疗器械,境内生产企业需要在所在地市药监局进行备案,境外医疗器械生产企业需要委托境内代理人在NMPA进行备案。
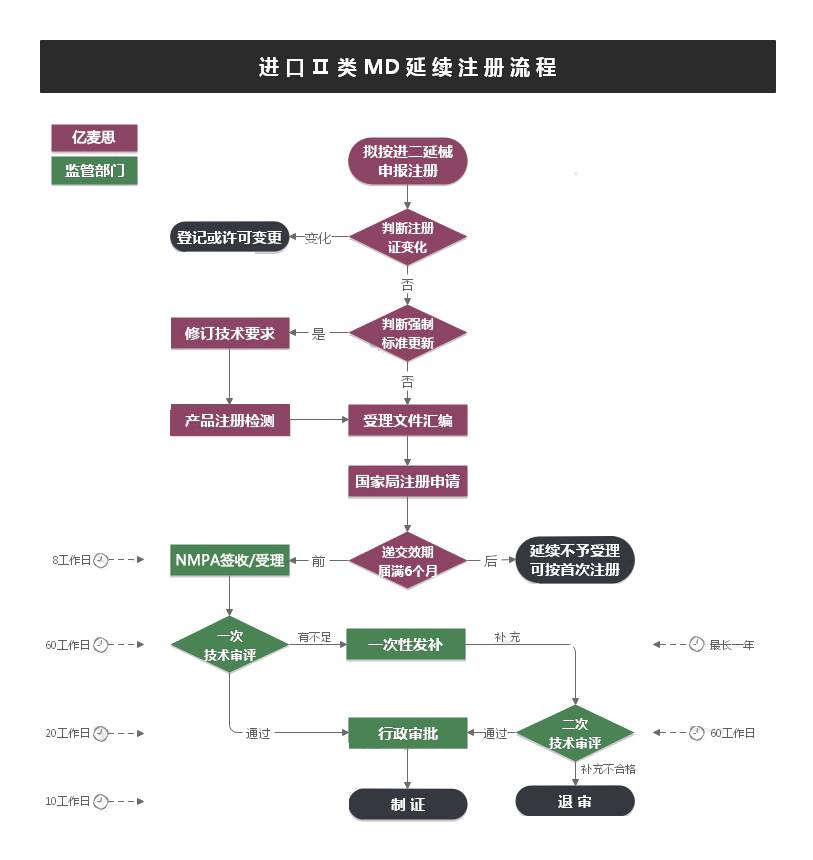
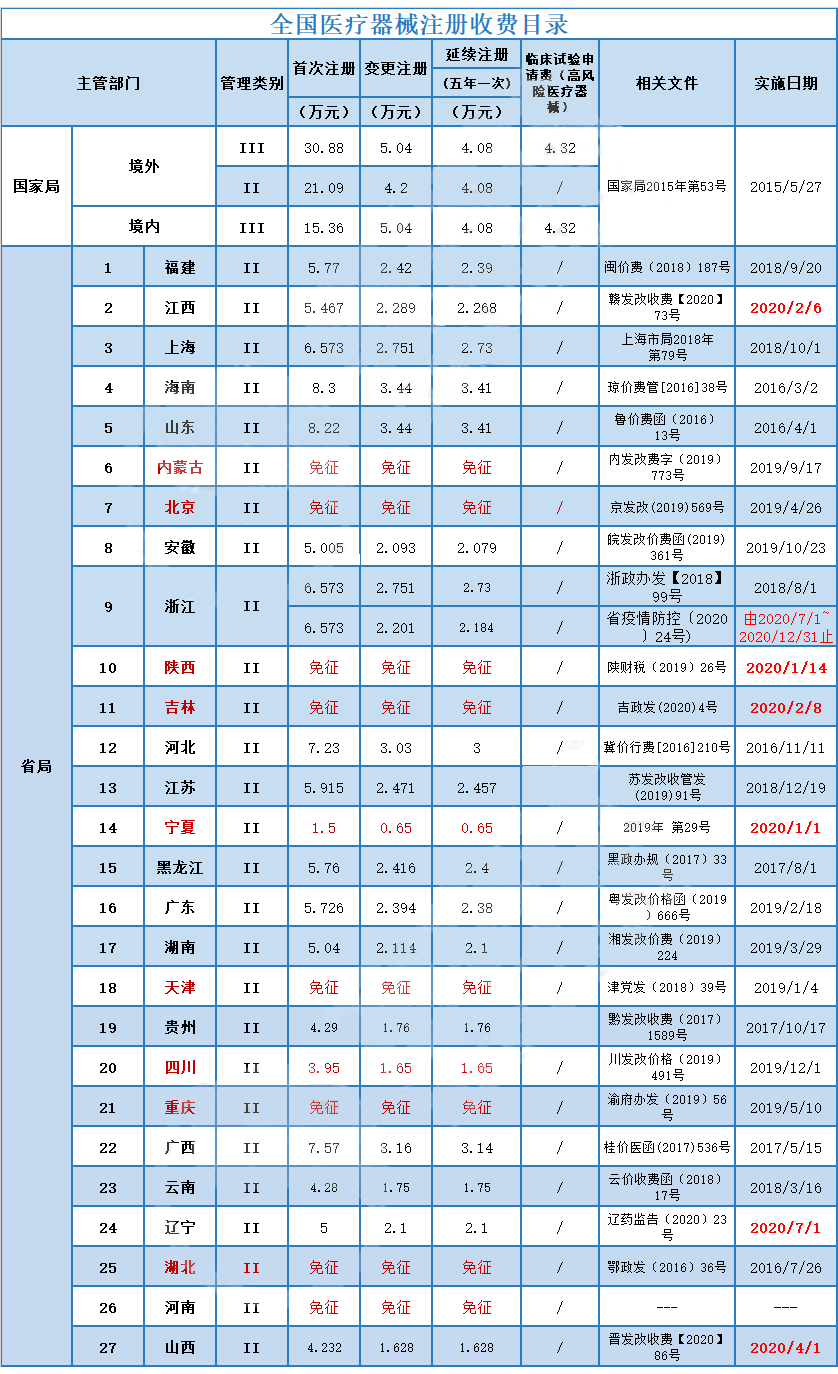
第Ⅱ类是具有中度风险,需要严格控制管理以**其安全、有效的医疗器械,境内生产企业需要在所在地省(直辖市)药监局进行注册,境外医疗器械生产企业需要委托境内代理人在NMPA进行注册。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以**其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在NMPA进行注册。