《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
根据产品风险程度的高低,体外诊断试剂依次分为第三类、第二类、第一类产品。
第一类体外诊断试剂实行备案管理,第二类、第三类体外诊断试剂实行注册管理。
境内第一类体外诊断试剂备案,备案人向设区的市级食品药品监督管理部门提交备案资料。
境内第二类体外诊断试剂由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。
境内第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。
进口第一类体外诊断试剂备案,备案人向国家食品药品监督管理总局提交备案资料。
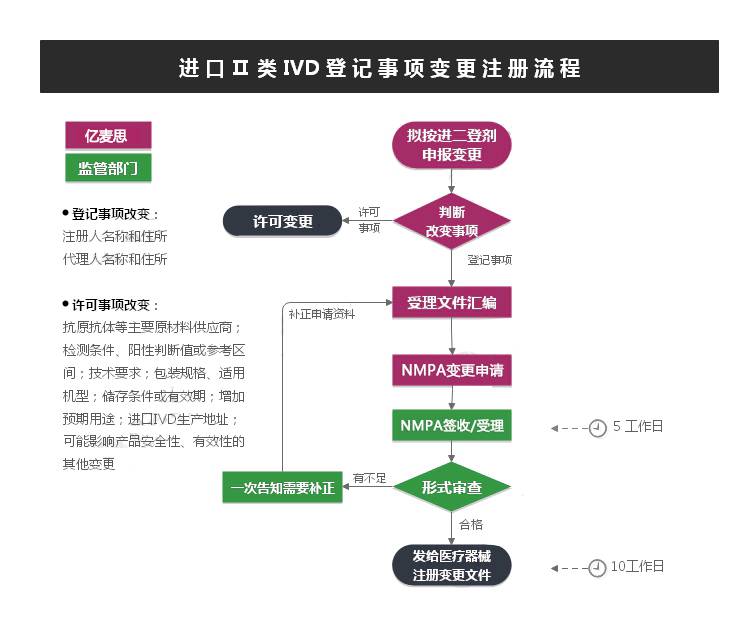
进口第二类、第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。
香港、澳门、台湾地区体外诊断试剂的注册、备案,参照进口体外诊断试剂办理。