《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于《体外诊断试剂注册管理办法》的管理范围。

《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于《体外诊断试剂注册管理办法》的管理范围。
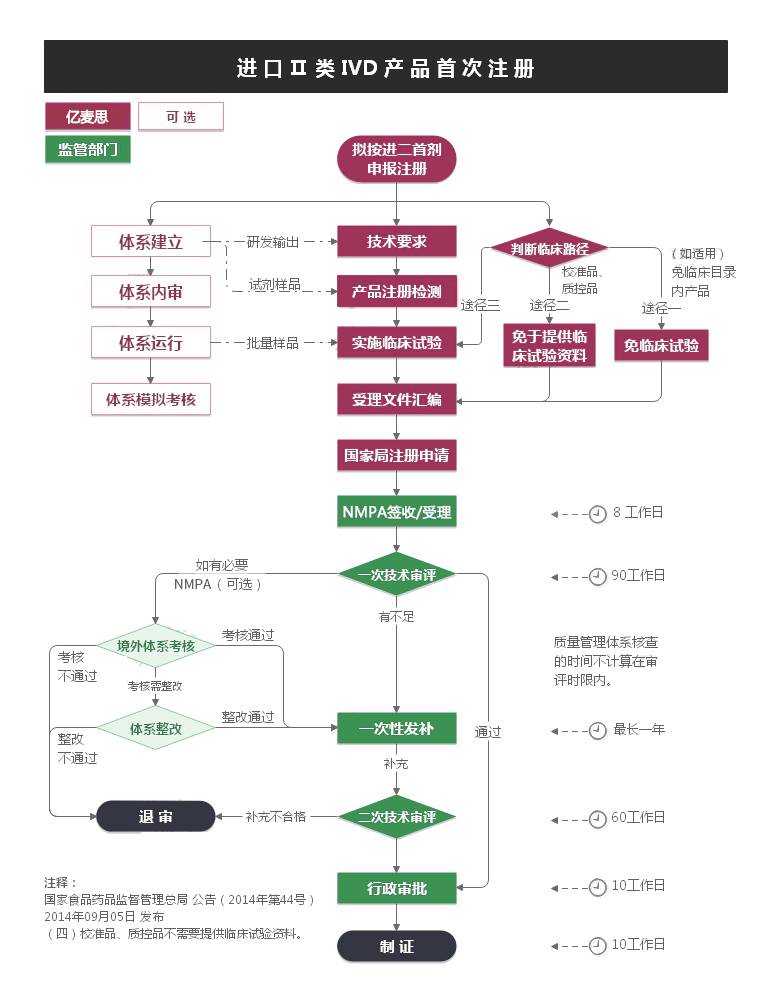
预算、合同、考虑期,1个月。
资料提供、翻译及公证 2-3个月
产品检测,视产品情况有所变化。 平均6个月
临床试验不可与检测并行,临床应单独核算时间。 至少9个月
注册资料编制可与检测或临床并行。
NMPA法定消耗预算8个月。(158工日,20工日/月,不计节假) 至少8个月
发补时限0~12个月视产品首次申报资料情况而定。平均6个月
无临床试验进二械首 预算平均24个月
有临床试验进二械首 预算应考虑33个月。
注册过程策划服务
首次注册服务
临床试验服务
注册、体系、临床培训服务
临床评价资料撰写服务
生产许可服务